Tercer Milenio

En colaboración con ITA
Vacunas de ARN mensajero: el freno a la pandemia que valió un Nobel
El Nobel de Medicina ha reconocido los estudios sobre la interacción del ARN mensajero con el sistema inmunitario, clave en las vacunas anticovid.

Imagina una gigantesca biblioteca que solamente contiene manuales de instrucciones. Libros que te explican cómo hacer cualquier cosa. Algunos son libros de recetas, otros te enseñan a arreglar un enchufe y también los hay para conectar tu impresora recién comprada al wifi de tu casa.
Por más útiles que sean, un libro por sí solo no sirve de nada. Un libro no puede coger entre sus páginas un destornillador y lanzarse a arreglar un enchufe por cuenta propia. Hace falta que alguien lo lea y ejecute paso a paso sus instrucciones. Algo parecido ocurre en nuestras células con el ADN.
Aunque acapare todas las portadas, el ADN no es más que un libro: si no es leído, de nada sirve. El ADN contiene las instrucciones para hacer funcionar nuestro cuerpo, aunque en este caso al ‘leer’ este manual no prepararemos unos macarrones con tomate ni arreglaremos ningún enchufe. Estas instrucciones permiten fabricar proteínas, las verdaderas responsables de que las células puedan funcionar.
En las células, es el ARN mensajero el responsable de leer el manual. Esta molécula puede interpretar la información que contiene el ADN para poner en marcha la síntesis de las proteínas que sean necesarias. Por tanto, necesitamos a cada uno de los miembros de esta tríada, el ADN, el ARN mensajero o ARNm y las proteínas para que las células funcionen correctamente.
A veces, un manual de instrucciones puede contener un error. Al seguir esas instrucciones equivocadas prepararemos un plato incomible o un enchufe que dé calambre. Sin embargo, si es el ADN el que tiene fallos, que en jerga científica llamamos mutaciones perjudiciales, el resultado serán proteínas que no funcionen. Siendo que las proteínas son las que se encargan de que todo marche correctamente en las células, si estos engranajes fallan puede ser fatal. Esto tiene como resultado distintas enfermedades, muchas de las cuales no tienen cura a día de hoy.
Los esfuerzos terapéuticos se suelen centrar en terapia génica, para así corregir la mutación y lograr proteínas que funcionen bien. También es posible, en algunos casos, administrar la proteína que no funciona o, en otros casos, tratar de eliminarla. Esto último es importante en casos en los que la proteína fallida se deposita en la célula y le impide funcionar con normalidad. Pero, ¿por qué no recurrir al intermediario entre ADN y proteínas?
Una molécula inestable
La respuesta es descorazonadoramente simple: el ARN mensajero es una molécula muy inestable. Mientras que el ADN es una molécula muy resistente, lo que nos ha permitido analizarlo en muestras que tienen muchos años de antigüedad, el ARNm se degrada con mucha facilidad. Tanto es así que, en el ámbito científico, solemos tildar a esta molécula de ‘incordio’.
A lo largo de los años se han dedicado muchos esfuerzos a mejorar la estabilidad del ARN mensajero, para así contar con una herramienta más en terapia. Los avances en nanomedicina fueron una interesante ayuda, ya que se consiguió hacer más resistente a esta molécula al encapsularla en diminutas vesículas lipídicas. No obstante, al administrar estas nanovesículas, se descubrió con gran disgusto que provocaban inflamación. Otro bache en un camino que ya de por sí estaba mal asfaltado.
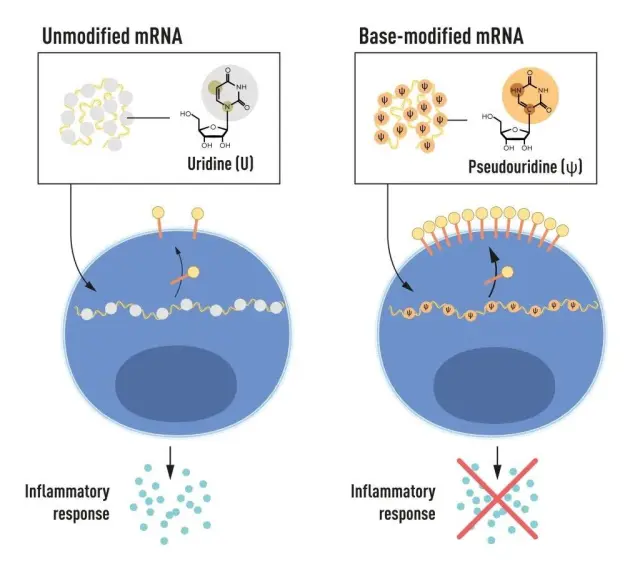
La inflamación era desconcertante. ¿Por qué algo que producen las células a diario sienta mal al administrarlo con una jeringuilla? A principios de los años 2000, la bioquímica Katalin Karikó y el inmunólogo Drew Weissman, tras años de investigación, formularon la siguiente hipótesis: las células modifican químicamente su ARN mensajero, pero el ARNm del laboratorio no es modificado. Esta diferencia podría hacer saltar las alarmas del cuerpo.
Para probar su hipótesis, modificaron el ARNm sintetizado en el laboratorio como lo haría una célula. Luego, lo pusieron en contacto con un tipo de células del sistema inmunitario. Éxito rotundo: las células del sistema inmunitario no confundían al ARNm modificado con algo peligroso, por lo que desaparecía la inflamación.
Animados tras este logro, ambos investigadores continuaron trabajando en esta línea de investigación. Un par de años más tarde, consiguieron, además, modificar la estructura del ARN mensajero de modo que se produjese una cantidad de proteína mayor. Estos dos descubrimientos derribaban las barreras que impedían recurrir al ARNm en terapia. Bien valen un Nobel.
¿Cómo funciona la vacuna frente a la covid-19?
En el año 2010, Karikó y Weissman ya habían publicado varios artículos científicos en los que recogían sus investigaciones sobre el ARN mensajero en terapia. Esto despertó el interés de varias compañías farmacéuticas, que vieron el potencial de esta tecnología para desarrollar vacunas.
Esto suponía un importante cambio de paradigma, pues implicaba crear un tipo de vacuna completamente nuevo. Hasta ese momento, las vacunas, destinadas a prevenir una enfermedad causada por un agente infeccioso o bien a pasarla de forma leve, se clasificaban en cuatro grandes grupos: vivas atenuadas, inactivadas, de subunidades y de toxoides.
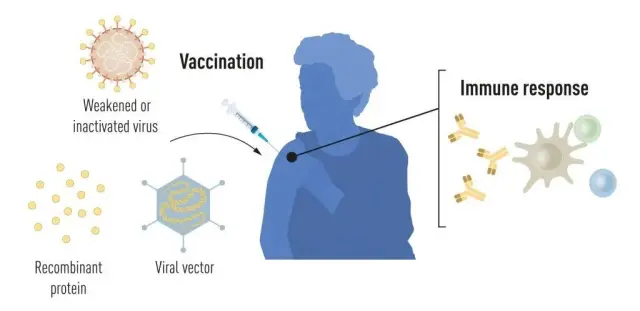
Las vacunas vivas atenuadas, como la de la varicela o el sarampión, contienen una versión debilitada del agente infeccioso de interés. Las vacunas inactivadas, como la de la gripe, cuentan con un agente infeccioso inactivado. Las vacunas de subunidades, como la de la hepatitis B, son un poco diferentes, ya que no contienen al agente infeccioso en su totalidad, sino solo a una parte, como proteínas de la parte externa, que es lo que reconocerá el sistema inmunitario. Por último, las vacunas de toxoides tampoco contienen un patógeno en sí, sino a una toxina que produce, como la de la difteria o el tétanos, que es lo que nos causa la enfermedad.
Las vacunas con ARNm guardan más parecido a estos dos últimos tipos de vacunas que a las que contienen un patógeno atenuado o inactivado, ya que tampoco van a incluir un agente infeccioso. Casi podríamos meter a las vacunas de ARNm mensajero dentro de las vacunas de subunidad, pues también contienen una parte del patógeno. En este caso, se trata de un fragmento de su ARNm. Sin embargo, hay una diferencia importante entre las vacunas de subunidad clásicas y las de ARNm. Mientras que la proteína o cualquier otra parte del agente infeccioso que se usa en las vacunas de subunidad ya hacen saltar las alarmas de nuestro cuerpo por sí solas, las vacunas de ARNm necesitan un paso adicional para ello: que nuestras células tomen ese ARNm, pensando que se trata de un fragmento del propio cuerpo, y lo usen para producir una proteína.
Este proceso no entraña el menor riesgo para las células, ya que no se trata de una proteína tóxica o dañina, pero al sistema inmunitario no le va a hacer ninguna gracia encontrar algo que es completamente ajeno al cuerpo. Así que, cuando dé con esta proteína, se activará la respuesta inmunitaria y se crearán células de memoria para volver a combatirla si vuelve a aparecer en el futuro. Si, tiempo después, entramos de verdad en contacto con el patógeno al que pertenece esa proteína, nuestro cuerpo estará preparado para eliminar la amenaza en un santiamén.
Una de las enfermedades frente a las cuales se estaba desarrollando una nueva vacuna de ARN mensajero era la causada por el virus MERS-CoV. Este coronavirus, que produce el síndrome respiratorio de Oriente Medio, tenía en guardia a la salud pública desde 2012, cuando fue detectado por primera vez. Además de ser una amenaza por sí solo, el MERS-CoV guarda cierto parecido con el SARS-CoV-2 que produce la covid-19, por lo que, cuando surgió este último, las compañías farmacéuticas ya tenían parte de los deberes hechos. Por eso, a finales de 2020 ya se contaba con nuevas vacunas altamente eficaces.
2020: el miedo a lo desconocido
Cuando las nuevas vacunas basadas en ARN mensajero aparecieron como caídas del cielo para poner freno a la covid-19, fueron muchos los que, en lugar de recibirlas con los brazos abiertos, recelaron. Aunque se llevaba un buen número de años trabajando en desarrollar estas nuevas vacunas, al no haberse obtenido hasta el momento éxitos destacados y comentados en prensa, para el grueso de la población esta tecnología era una gran desconocida. Y no solo la tecnología, sino que el propio ARN mensajero era un concepto que, al no ser tan familiar como el ADN o las proteínas, resultaba ajeno. Además, al desarrollarse unas cuantas vacunas en relativamente poco tiempo, había quien afirmaba con vehemencia que no se habían realizado los controles necesarios para garantizar su seguridad. Algo, por supuesto, en absoluto cierto.
No obstante, es lícito que surjan dudas y exigir respuestas, especialmente al atravesar un momento tan incierto como el que pasamos a partir de marzo del 2020. Los expertos tienen entonces la gran (y, en muchas ocasiones, nada sencilla) responsabilidad de proporcionar información clara para generar tranquilidad y confianza. No solo eso, sino que se debe hacer un esfuerzo extra en combatir bulos y mentiras malintencionadas que atentan contra la salud pública.
Años de ventaja
Sí, hubo una carrera contrarreloj frente a la covid-19, pero, por suerte para todos nosotros, la investigación en ARNm le llevaba años de ventaja. Gracias al duro esfuerzo de Karikó, Weissman y otros muchos investigadores durante décadas, poder recurrir al ARNm con fines terapéuticos es ahora una realidad. La pandemia aceleró el proceso, pero más tarde o más temprano habríamos acabado conociendo en detalle a esta molécula y todo lo que podrá hacer por nosotros en un futuro no muy lejano.
-Ir al suplemento Tercer Milenio
Apúntate y recibe cada semana en tu correo la newsletter de ciencia