Tercer Milenio

En colaboración con ITA
Investigación
Terapia génica: buscando una cura para las enfermedades raras
Distintos estudios con resultados prometedores han abierto la puerta a la aprobación de las primeras terapias génicas para un tipo de ceguera congénita y una forma de atrofia muscular. Actualmente existen muchas más en estudio para patologías hasta ahora incurables o de difícil tratamiento, entre las que se encuentra un raro síndrome de inmunodeficiencia.
De pequeña, Josselyn Kish, una niña de Las Vegas (Estados Unidos), padecía a menudo erupciones cutáneas, dolorosos brotes de herpes zóster y constantes diarreas. Su madre explica que la llamaban de la guardería un par de veces por semana para que la fuese a recoger porque siempre tenía fiebre. Josselyn, que actualmente tiene 11 años, sufre una enfermedad genética rara popularmente conocida como el síndrome del ‘niño burbuja’.
En términos médicos, la dolencia de Josselyn se denomina síndrome de inmunodeficiencia combinada grave (SCID, por sus siglas en inglés), nombre con el que se designa a un conjunto de enfermedades genéticas hereditarias caracterizadas por un mal funcionamiento del sistema inmunitario. Los niños con SCID sufren frecuentes infecciones, por ejemplo del oído, respiratorias como neumonía o bronquitis, candidiasis orales y diarrea. Ello se debe a que tienen alterada la respuesta tanto de los linfocitos T como de los linfocitos B.
Los primeros son las células de la sangre que normalmente estimulan a otras células inmunitarias a combatir las infecciones, mientras que los segundos se encargan de producir anticuerpos neutralizantes. De ahí el nombre ‘inmunodeficiencia combinada’. Como consecuencia de ello, cualquier infección, por leve que sea, puede resultar fatal.
Debido a las múltiples infecciones, los niños con SCID tienen problemas para ganar peso y crecer normalmente y, sin tratamiento, rara vez vivirían más allá de los dos años. La única cura que existe es el trasplante de médula ósea de una donante sano.
La médula contiene células madre hematopoyéticas que pueden formar todos los tipos de células sanguíneas: los glóbulos rojos, las plaquetas, y también los glóbulos blancos, entre los que se encuentran los linfocitos T y B. Estos últimos son una parte esencial de nuestro sistema inmunitario y nos ayudan a combatir infecciones y otras enfermedades. Para que el trasplante sea efectivo, debe provenir de un donante compatible, generalmente un hermano o hermana del paciente, pero en la mayoría de casos no existe tal posibilidad e igualmente el procedimiento conlleva riesgos.
20 genes distintos
Aunque la inmunodeficiencia combinada es una enfermedad rara, ha sido ampliamente estudiada durante las últimas décadas debido al conocimiento que ha aportado a los científicos sobre el funcionamiento del sistema inmunitario. Se conocen unos 20 genes distintos que la causan. La forma más común es la de David Vetter, ‘el Niño Burbuja’ , que se hereda ligada al sexo: las madres son portadoras sanas y transmiten la enfermedad a la mitad de sus hijos de sexo masculino, los que heredan el cromosoma X que porta la mutación. Está producida por mutaciones en el gen IL2RG, situado en el cromosoma X y que, en condiciones normales, dicta a los linfocitos las instrucciones para fabricar parte de un receptor importante para su maduración.
Otras formas afectan por igual a ambos sexos. Como la de Josselyn Kish, producida por mutaciones en el gen ADA, que codifica la adenosina desaminasa. Entre otras funciones, esta enzima actúa en los linfocitos como un mecanismo protector: elimina un metabolito tóxico que si se acumulase, los mataría. Para protegerse de las infecciones graves, las personas con ADA-SCID deben recibir dosis de antibióticos, anticuerpos y también terapia sustitutiva con inyecciones semanales de la enzima. Pero todas estas medidas no dejan de ser provisionales y no representan una cura definitiva.
Para estos pacientes, y para tantos otros aquejados de enfermedades hereditarias raras, una terapia génica que atajase el problema de raíz –el defecto genético– podría ser la solución. Curiosamente, en los estudios iniciales de terapia génica, en los años noventa, el SCID fue la primera enfermedad humana tratada mediante esta estrategia. Desde entonces, ha habido momentos críticos y trascendentales, pero en los últimos años, el conocimiento acumulado y las mejoras metodológicas han permitido que se aprobasen las primeras terapias génicas y que muchas otras se estén probando en ensayos clínicos.
Recientemente, un estudio publicado en ‘New England Journal of Medicine’ y presentado en el congreso de la Sociedad Americana de Terapia Génica y Celular, ha demostrado que más de dos años después de haber recibido un tratamiento experimental basado en terapia génica para regenerar su sistema inmunitario, cerca de 50 niños que padecían ADA-SCID, entre los que se encuentra Josselyn Kish, pueden llevar una vida normal. Según Donald Kohn, médico que lidera el estudio desde el Hospital Infantil de la Universidad de California en Los Ángeles, los niños tratados "fundamentalmente son libres, van a la escuela, hacen cosas normales" y no tienen que preocuparse de que una infección pueda terminar con su vida.
Los investigadores extrajeron células madre hematopoyéticas de los pacientes y utilizaron un ayudante inesperado: un lentivirus similar al virus del sida, pero modificado, para introducirles una versión normal del gen ADA antes de volver a inyectar las células a los pacientes.
La ventaja de este enfoque es que emplea células del propio paciente y, por lo tanto, no existe el peligro de rechazo que puede tener la médula de un donante. El virus empleado como vector está diseñado para minimizar el riesgo de que el material genético se inserte en un lugar no deseado del genoma de los pacientes y produzca un cáncer, como por ejemplo una leucemia. En 48 de los 50 niños tratados en Estados Unidos y el Reino Unido, las células se implantaron correctamente y reconstituyeron un sistema inmunitario funcional que les ha permitido prescindir de la terapia con anticuerpos o con la enzima ADA. Más de dos años después del tratamiento, sus efectos beneficiosos se mantienen y ninguno de los niños ha desarrollado leucemia.
David Vetter, ‘el Niño Burbuja’
El caso de David Vetter pasó al imaginario colectivo como ‘el Niño Burbuja’ y, además de inspirar una película, dio el nombre popular a su enfermedad: el síndrome de inmunodeficiencia combinada grave. En la década de los setenta, este niño de Texas vivió 12 años aislado del mundo exterior, primero en una cámara de plástico y, a partir de los 6 años, fuera de ella gracias a un traje especial diseñado por la NASA para protegerlo de los gérmenes. Su hermano mayor había fallecido con 7 meses de edad debido a la misma enfermedad y, aun sabiendo que existía una probabilidad del 50% de que un futuro hijo de sexo masculino también la heredase, sus padres decidieron tener más niños. David nació en 1971 afectado por el SCID. Sin un sistema inmunitario funcional, debía permanecer en un entorno totalmente estéril para sobrevivir hasta encontrar un donante de médula compatible. Finalmente en 1984, David recibió un trasplante de su hermana Katherine, pero desgraciadamente, cuatro meses después falleció por un linfoma de Burkitt, producido por un virus de Epstein-Barr latente que no había sido detectado en el cribado previo.
¿En qué consiste la terapia génica?
La terapia génica tiene como objetivo reemplazar o corregir los genes defectuosos responsables de distintas enfermedades. De alguna forma equivaldría a sustituir o reparar una pieza estropeada en una máquina, en este caso un tejido o un órgano de nuestro cuerpo, para que pueda funcionar correctamente.
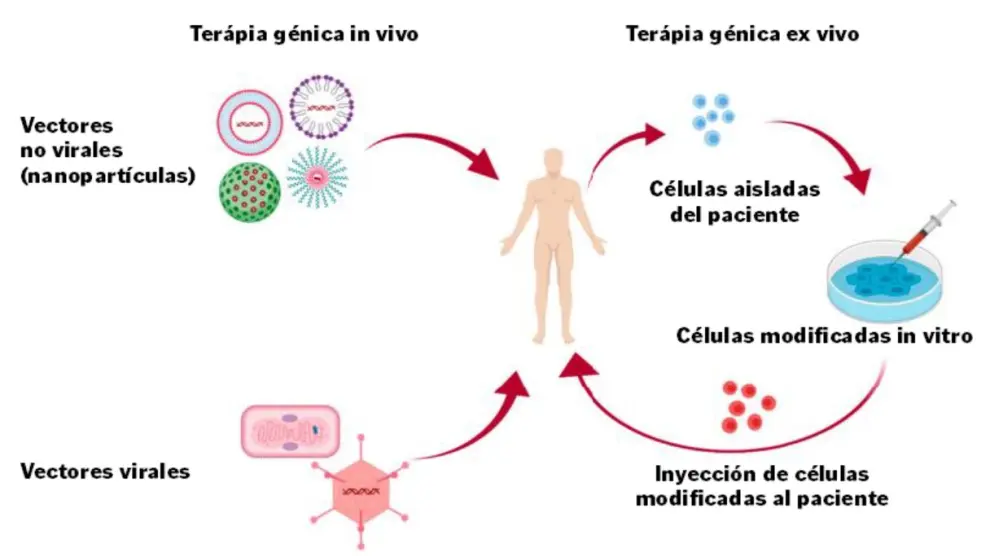
Introducir dentro de nuestras células la copia correcta del gen, la pieza funcional, no es un asunto baladí. Para conseguirlo, los investigadores emplean distintos vectores. Uno de los más comunes son los virus, que se modifican en el laboratorio y en los que se sustituye su material genético por el gen humano de interés. De esta forma ya no son patogénicos, pero conservan su capacidad de penetrar en nuestras células e insertar el gen terapéutico para que pueda suplir la falta de función celular.
Algunos de los obstáculos con los que se encuentra el uso de vectores virales son la posibilidad de una estimulación no prevista del sistema inmunitario del paciente que conlleve efectos adversos o de una respuesta inmune contra el vector viral que reduzca la efectividad de la terapia. Hasta el 50% de los pacientes están actualmente excluidos del tratamiento debido a una inmunidad preexistente contra el envoltorio de algunos virus. Por ello, se modifican las proteínas de las cápsides de los virus utilizados para que evadan los anticuerpos neutralizantes preexistentes o se trata a los pacientes con fármacos inmunosupresores.
Otras estrategias no virales emplean nanopartículas que, a diferencia de los virus, tienen el potencial de eludir la detección por parte del sistema inmunitario. También se puede modificar su composición para que la introducción de genes terapéuticos en las células de los pacientes sea más eficiente o para dirigir de forma más específica la terapia hacia el tejido diana, como se hace con los virus adenoasociados.
Existen dos tipos de terapia génica. Las terapias ‘in vivo’ se administran directamente al paciente, dirigidas específicamente a las células o tejidos afectados por la enfermedad.
En cambio, en las terapias ‘ex vivo’ se aíslan células del propio paciente, que se modifican genéticamente en el laboratorio para corregir la alteración y, finalmente, se vuelven a introducir. La estrategia ‘ex vivo’ se está utilizando para tratar enfermedades de la sangre o del sistema inmune, como por ejemplo la betatalasemia o distintas formas de SCID. También se emplea en la inmunoterapia con células CAR-T para el tratamiento de leucemias y linfomas de células B que no responden a la terapia habitual. En este caso, se modifican genéticamente linfocitos T obtenidos del paciente para que expresen un receptor artificial que les confiere la capacidad de reconocer y destruir las células cancerígenas.
Las primeras terapias aprobadas
Aunque las terapias génicas se conceptualizaron y empezaron a ensayar hace décadas, durante mucho tiempo se han mantenido en el ámbito de la investigación. Las promesas iniciales de poder tratar un sinfín de enfermedades hasta el momento incurables, dieron paso a un baño de realismo. A pesar de eso, el conocimiento acumulado en este campo durante la última década condujo a la aprobación en Europa, en 2012, de la primera terapia génica, Glybera, para la deficiencia de lipoproteína lipasa, un trastorno hereditario raro que puede causar pancreatitis grave. Tanto su alto coste, que le valió el calificativo de ‘medicamento de un millón de dólares’, como el bajo número de pacientes afectados, contribuyeron a que se dejase de comercializar. Aun así, con Glybera se demostró que una terapia génica podía llegar a ser aprobada, y en los últimos años el desarrollo de nuevas terapias se ha acelerado.
En 2017 se aprobó Luxturna para el tratamiento de una forma rara de ceguera infantil, la amaurosis congénita de Leber, producida por mutaciones en el gen RPE65. Luxturna es la primera terapia para una distrofia de la retina, un conjunto de patologías que afectan la visión, causadas por más de 270 genes. Por ello, este es un campo en el que existe un interés evidente y ya se están investigando muchas otras terapias; también por el fácil acceso al tejido diana, la retina, y porque el ojo está relativamente protegido de las respuestas inmunitarias e inflamatorias.
Otras terapias génicas ya aprobadas son Zolgensma, para la atrofia muscular espinal de tipo 1, una enfermedad genética que impide el desarrollo adecuado de los músculos y que suele causar la muerte durante los primeros años de vida; Strimelis, para la inmunodeficiencia combinada grave por déficit de adenosina deaminasa (ADA-SCID), inicialmente aprobada en Europa en 2016 y que se sigue investigando; y Zynteglo, para el tratamiento de la beta-talasemia dependiente de transfusiones (TDT).
Edición genética
Más allá de reemplazar genes alterados, una nueva generación de terapias busca corregir de forma precisa la secuencia del gen (la mutación o alteración genética), empleando sofisticadas técnicas de edición genética como Crispr/Cas9, que les valió el premio Nobel de Química de 2020 a Jennifer Doudna y a Emmanuelle Charpentier. Los primeros ejemplos de la eficacia de la edición génica basada en la técnica Crispr para tratar enfermedades raras se produjeron en 2019, en ensayos clínicos para la anemia de células falciformes y la betatalasemia; ambas terapias ex vivo. La primera terapia de edición génica in vivo en estudio se administró hace un año a los primeros pacientes afectados de otro tipo de ceguera congénita.
-Ir al suplemento Tercer Milenio
Apúntate y recibe cada semana en tu correo la newsletter de Tercer Milenio