Tercer Milenio

En colaboración con ITA
Cuando el sistema inmunitario se descontrola
Así nos defiende nuestro sistema inmunitario... y qué sucede si confunde estructuras propias con una amenaza.
Antígenos. Memoria inmunológica. Linfocitos. Anticuerpos. Nuestro sistema inmunitario es la nueva gran estrella de Hollywood, aunque dadas las circunstancias que lo han catapultado a la fama, por desgracia de sobra conocidas por todos, ojalá hubiese seguido siendo un desconocido para el gran público. Pero ya que los tiempos que corren nos han obligado a aprender sobre él a marchas forzadas, qué menos que descubrir uno de los sistemas más fascinantes de nuestro cuerpo (no, cerebro, tú también eres genial pero ahora no estamos hablando de ti, siéntate ahí quietecito un rato).
El sistema inmunitario se encarga de gestionar todo aquello que amenace a nuestra salud, ya sea ajeno, como un virus, o propio, como un tumor. Lo componen varios agentes clave que podemos agrupar en dos categorías: los responsables de la respuesta innata y los ídem de la respuesta adaptativa.
Respuesta innata
La respuesta innata se activa en primer lugar en cuanto se detecta algo que no debería estar en el organismo. Ese 'algo' extraño es lo que se denomina antígeno, y puede ser desde una molécula que se encuentra en la superficie de una bacteria patógena hasta una proteína alterada que posea una célula tumoral en su membrana.
Ante esta amenaza desconocida van a responder los granulocitos, las células dendríticas, los macrófagos y las células 'natural killer', nombre que no se tradujo al español porque 'Asesinos natos' ya estaba cogido por aquella película de los 90 protagonizada por Woody Harrelson. O porque 'natural killer' suena estupendamente. A saber.
Respuesta adquirida
Mientras los agentes de la inmunidad innata lidian con la amenaza, se va despertando el león dormido: la respuesta adquirida comienza. Este proceso no es inmediato porque se requiere de una exposición previa a un antígeno y de la existencia de memoria inmunológica para actuar con fuerza. De la inmunidad adquirida se encargan los linfocitos T y B; estos últimos son los productores de los anticuerpos, unas proteínas que reconocen a un antígeno concreto y se unen a él, atrayendo a las células del sistema inmunitario para que procedan a su eliminación.
Los anticuerpos son unos de los grandes responsables de que la memoria inmunológica se mantenga a lo largo del tiempo y permiten que nuestro cuerpo esté mejor preparado para enfrentarse a un patógeno que nos infecta por segunda vez, ya que facilitan su reconocimiento y la activación de la respuesta adquirida.
Cuando algo falla
Pero, por muy bien diseñada que esté una máquina, en un momento u otro va a cometer algún fallo. Uno de los errores más graves en los que puede caer el sistema inmunitario consiste en confundir estructuras propias con una amenaza y proceder a su destrucción. Esta es la base de las enfermedades autoinmunes.
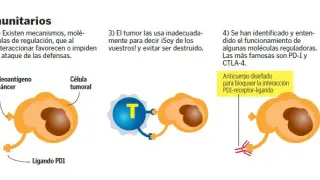
También es posible que ocurra lo contrario, que no se detecte un antígeno y la amenaza campe a sus anchas por nuestro organismo. Los tumores, por ejemplo, pueden desarrollar estrategias para evitar la vigilancia inmune y así continuar creciendo hasta que es demasiado tarde para el organismo y tiene que intervenir el médico para atajar la enfermedad.
Y, como no hay dos sin tres, el sistema inmunitario también puede equivocarse y reaccionar de forma exagerada ante amenazas que no lo son tanto, como las alergias, y hacérselo pasar bastante mal a quien lo sufre, que se pasa un mes moqueando por los rincones por un poco de inofensivo polen.
Por suerte, existen estrategias farmacológicas con las que modular la actividad del sistema inmunitario y reducir el impacto de sus fallos. En el caso de las enfermedades autoinmunes, están dirigidas a reducir la actividad del sistema inmunitario para así evitar que dañe estructuras propias. Antiguamente, se optaba por la misma solución que cuando se llevaba a cabo un trasplante: inducir la inmunosupresión, esto es, dejar el sistema inmunitario tiritando.
La inmunosupresión consiste en reducir al mínimo la actividad del sistema inmunitario, una medida desesperada que debe tomarse en situaciones desesperadas, como los trasplantes, pero que no es del todo adecuada para el manejo de una enfermedad crónica como son los trastornos autoinmunes, ya que el paciente quedaría desprotegido frente a cualquier amenaza.
Existen diferentes estrategias de inmunomodulación a las que recurrir frente a un problema de esta clase. Entre ellas, reducir el efecto de los agentes pro-inflamatorios del sistema inmunitario y la modificación del metabolismo de las células del sistema inmunitario, lo que para abreviar se llama inmunometabolismo.
Contra la tormenta de citoquinas
Vamos con el primero. ¿Qué son estos agentes pro-inflamatorios que aparecen ahora de golpe y porrazo? Son unas sustancias producidas por nuestras células del sistema inmunitario, por ejemplo, los macrófagos o los linfocitos, cuya misión es atraer al resto de agentes implicados en combatir la infección. Es decir, la inflamación es la señal luminosa que guía al avión para aterrizar y consigue centrar la atención del sistema inmunitario en un punto concreto del organismo. No obstante, un proceso inflamatorio descontrolado puede tener repercusiones muy graves.
Se cree que esta podría ser una de las causas de mortalidad en pacientes con un sistema inmunitario sano asociadas a la infección por SARS-CoV2: la llamada tormenta de citoquinas. Las citoquinas son uno de estos agentes pro-inflamatorios generados por las células del sistema inmunitario; cuando la infección está controlada, su producción cesa y se retorna a un estadio de no inflamación, pero, si no se controla la infección, esta producción es continua y cada vez mayor, produciendo graves daños en el tejido infectado.
También en las enfermedades autoinmunes existe una producción continua de citoquinas y otros agentes pro-inflamatorios, de modo que se han diseñado formas de bloquearlas. El uso de anticuerpos dirigidos frente a estas moléculas es una opción bastante interesante, subcontratamos a la naturaleza para que sea ella quien nos proporcione los fármacos. Ojo, aquí no es nuestro propio cuerpo quien sintetiza estos anticuerpos, solo copiamos su sistema y lo escalamos para producirlos en masa. Los anticuerpos se unirán a los agentes pro-inflamatorios y los bloquearán, impidiéndoles llevar a cabo su función. Sin agentes pro-inflamatorios, no hay inflamación. Problema resuelto.
No obstante, esta solución no es perfecta. No todos los pacientes responden bien a esta terapia y, en ocasiones, puede conllevar ciertos efectos secundarios. Por eso, las investigaciones en este campo han continuado hasta dar con una nueva aproximación: la modulación del inmunometabolismo.
En los últimos años, se ha observado que las células del sistema inmunitario de los pacientes de trastornos autoinmunes podrían funcionar de esta manera atípica y perjudicial por la desregulación de algunas de sus rutas metabólicas, siendo el metabolismo el conjunto de reacciones químicas necesario para la vida de la célula. Por ejemplo, al estar activadas de forma permanente, estas células tienen una gran demanda de energía; además, la activación conlleva un cambio en el metabolismo, ya que pasan de utilizar unas rutas metabólicas a otras para satisfacer sus nuevos requisitos.
Este proceso de reprogramación celular proporciona toda una serie de nuevas dianas metabólicas hacia los que dirigir los futuros fármacos contra las enfermedades autoinmunes y otros trastornos que cursan con una respuesta exagerada del sistema inmunitario ya que, si se altera una ruta metabólica frente a la que la célula activada tiene una fuerte dependencia, puede llegarse a bloquear su actividad por completo.
Un ejemplo muy esperanzador lo encontramos en el uso de un análogo de la glucosa para el tratamiento del lupus, que al ser administrado junto con el fármaco metformina indujo un descenso en la producción de citoquinas pro-inflamatorias. Esta combinación de fármacos bloqueó una ruta metabólica denominada glucólisis, necesaria para que los linfocitos T activados obtengan energía, y además indujo el mal funcionamiento de las mitocondrias, unas estructuras celulares también implicadas en la producción de energía. Digamos que desenchufaron a los linfocitos T. Y, como se suele decir, muerto el perro, se acabó la rabia.
Inés Mármol Biotecnóloga. Doctoranda en el departamento de Farmacología y Fisiología de la Universidad de Zaragoza
-Ir al suplemento Tercer Milenio