Tercer Milenio

En colaboración con ITA
Reportaje
Proteínas dúctiles: lo flexible es útil
No plegarse como la bioquímica manda cargaba a ciertas proteínas con el sambenito de raras. Anomalías descartables. Hoy sabemos que esta flexibilidad es una ventaja que convierte a las proteínas dúctiles en perfectas parejas de baile. Por eso, es frecuente que participen en el reconocimiento y en la unión con otras biomoléculas. Mientras las proteínas estructuradas suelen especializarse en un cometido concreto, las proteínas dúctiles aportan la ventaja de poder realizar diferentes tareas y podrían haber sido clave en la evolución de los seres vivos. Divulgarlas puede convertirse en un canto a la igualdad: lo diferente no es un defecto.

Las proteínas son una parte esencial de las células y desempeñan múltiples funciones necesarias para la vida. Si pudiéramos ver una célula en todo su conjunto a nivel atómico observaríamos una sopa acuosa con numerosos componentes en su interior, algunos anclados o embebidos en redes o mallas densas (membranas de lípidos), otros navegando de un lugar a otro de forma orquestada, pautada y a veces altamente sincronizada. Entre estos componentes se encuentran las proteínas, que dibujan un escenario con múltiples formas y tamaños, como si fueran los instrumentos de una gran orquesta que interpreta complejas partituras, a veces sometidos a estímulos externos, como los golpes de tos o murmullos del público. Las células necesitan de las proteínas para su funcionamiento y supervivencia –almacenar la energía, mantener su integridad, defenderse de agentes externos y reparar daños, entre otras funciones–. Aunque todas las proteínas son polímeros lineales formados con solo 20 tipos de aminoácidos, entre ellas podemos distinguir diferentes formas (estructuras) que realizan diferentes funciones –enzimas, transportadores, hormonas, factores de transcripción–. De las proteínas dependen las diferencias que observamos entre los seres vivos, desde las bacterias a los seres humanos, pasando por los hongos, los animales invertebrados y vertebrados, y las plantas.
Estructura y función
El éxito de los estudios realizados desde mediados del siglo XX en numerosas proteínas mediante cristalografía y difracción de rayos X llevó a establecer que la estructura es un requisito indispensable para que una proteína realice una función. La función de las proteínas está vinculada a su estructura tridimensional, que varía según se combinen secuencialmente los aminoácidos que las componen a lo largo de una cadena y se plieguen con mayor o menor complejidad. La forma espacial o el plegamiento de las proteínas no es algo al azar, resulta de las interacciones entre las distribuciones de carga que hay en la proteína y en el agua que las rodea en la célula. Sin embargo, en los años ochenta del pasado siglo, como a veces suele ocurrir en la ciencia, se observaron fenómenos que no encajaban con el paradigma dominante.
Algunas proteínas escapaban de los procedimientos experimentales, no pudiéndose resolver sus estructuras con las técnicas disponibles. Ocasionalmente, se encontraban proteínas con ‘anomalías’, es decir, que no presentaban un correcto plegamiento según las reglas establecidas.
En algunos casos, las ‘anomalías’ se debían a defectos moleculares en la estructura de la proteína ocasionados, a menudo, por mutaciones genéticas. En otros casos, las ‘anomalías’ resultaban excepcionales, atribuidas a errores experimentales.
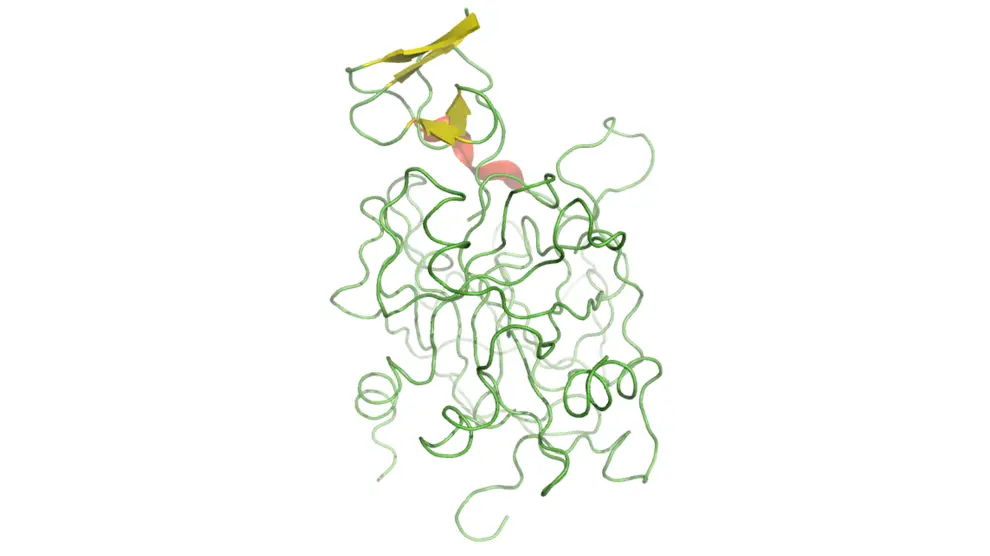
En general, en estos casos los científicos obvian lo que no encaja y se concentran en los objetivos principales de sus investigaciones. Normalmente aciertan, de ahí el vertiginoso progreso de la ciencia, pero no siempre es así. A veces, los fenómenos que no encajan con el paradigma dominante del momento acaban convirtiéndose en la pieza central de un nuevo paradigma. Este es el caso de las proteínas dúctiles –conocidas en inglés como Intrinsically Disordered Proteins (IDP)–, proteínas que no requieren una estructura tridimensional bien definida para realizar su función en la célula.
De anómalas a útiles
Lejos de haber sido olvidadas por la comunidad científica, debido a lo irregular y desordenado de su estructura, las proteínas dúctiles o IDP despertaron la curiosidad de algunos científicos, que desarrollaron herramientas computacionales e informáticas capaces de predecir, a partir de su secuencia, si una proteína adopta, o no, una estructura tridimensional bien definida.
Los trabajos de Keith Dunker y de otros investigadores han sido decisivos en este terreno, para establecer que, en contra de lo aceptado en el pasado siglo, la falta de estructura en las proteínas es también una característica útil –la flexibilidad y la ductilidad en las proteínas es una propiedad que a menudo resulta crucial para su funcionamiento–. Así, podemos encontrar que la estructura de las proteínas abarca un amplio abanico de formas, desde regiones con un plegamiento bien definido y estable, a regiones con plegamiento inestable. Los elementos estructurados y flexibles se complementan.
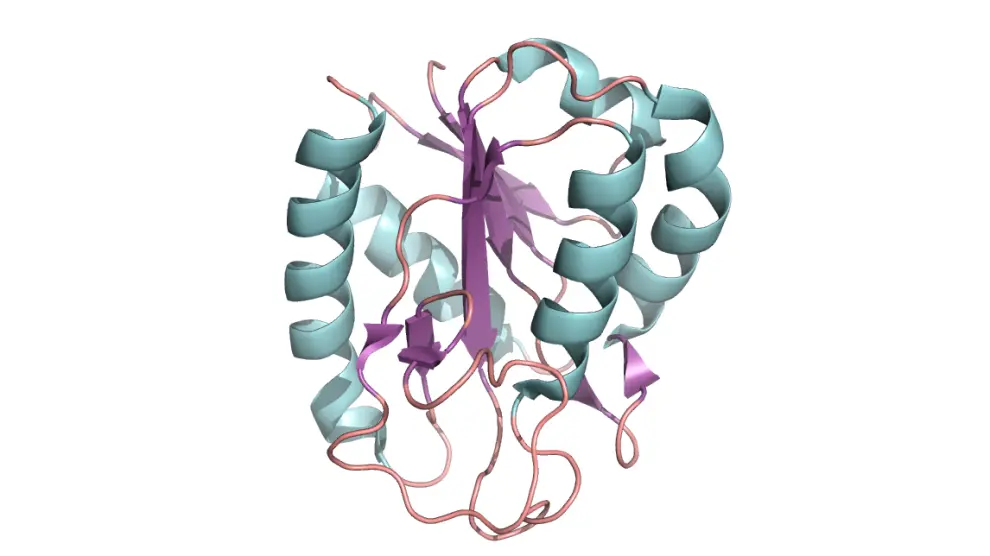
Las proteínas y regiones dúctiles son biológicamente activas e intervienen en el control del ciclo y división celular, en la actividad de las células, en la regulación de los genes y de las proteínas o en la señalización de los procesos biológicos. Las proteínas dúctiles realizan su tarea interaccionando y uniéndose a otras biomoléculas (ADN, ARN, proteínas, azúcares, metales). Es frecuente que participen en el reconocimiento y en la unión con otras biomoléculas, como si de una pareja de baile se tratara. Esta característica les permite realizar diferentes tareas, lo que les proporciona una ventaja respecto a las proteínas estructuradas que suelen estar optimizadas para una tarea concreta.

Algunos ejemplos de proteínas con una elevada proporción de regiones dúctiles son los factores de transcripción, los receptores hormonales, las histonas, las proteínas de los ribosomas, las proteínas del espliceosoma y numerosas enzimas complejas. Se estima que en los animales, humanos y plantas, las proteínas dúctiles representan más de una tercera parte del proteoma.
Un papel clave en la evolución de los seres vivos
Pese a las limitaciones de los métodos experimentales, desde finales de los años noventa del pasado siglo la información sobre las proteínas dúctiles ha crecido exponencialmente. El desarrollo de la genómica, la proteómica y las herramientas computacionales está contribuyendo y facilitando las investigaciones.
Se estima que el 80% del proteoma implicado en el desarrollo de los organismos eucariotas (formados por células con núcleo) contiene largas secuencias de baja complejidad estructural. Los trabajos del grupo de Biología Computacional y Estructural de la Estación Experimental de Aula Dei–CSIC liderados por Inmaculada Yruela en colaboración con el investigador Araid Bruno Contreras-Moreira indican que la ductilidad tiene un especial protagonismo en la evolución del cloroplasto que realiza la fotosíntesis en las plantas y en la evolución de los organismos verdes, desde las algas unicelulares hasta las plantas terrestres. El aumento de las regiones dúctiles en los organismos eucariotas y especialmente en los factores de transcripción que participan en el control del ciclo y división celular, en la diferenciación y la proliferación celular y otros importantes procesos de desarrollo, probablemente contribuyeron a la evolución de la complejidad de los organismos y a la multicelularidad.
Los eventos de duplicación sucedidos en los genomas de las plantas terrestres a lo largo de la evolución estabilizaron las funcionalidades adaptativas de los proteomas. Las proteínas dúctiles podrían haber desempeñado un papel clave durante la formación de los organismos multicelulares, la evolución y la adaptación a condiciones ambientales adversas.
Ductilidad y enfermedad
Los ejemplos investigados a pequeña escala permiten también establecer relaciones entre las proteínas dúctiles y ciertas enfermedades, como diversos tipos de cáncer, el alzhéimer, el párkinson, la esclerosis lateral amiotrófica (ELA), las enfermedades cardiovasculares, la diabetes de tipo II y algunas enfermedades infecciosas, entre otras.
Numerosos científicos trabajan en estos temas a nivel nacional e internacional, algunos de ellos investigan en el Instituto de Biocomputación y Física de Sistemas Complejos de la Universidad de Zaragoza y participan en una Unidad de I+D+i asociada al Consejo Superior de Investigaciones Científicas a través de la Estación Experimental de Aula Dei.
‘Molecular Plasticity’, divulgación en tres actos
La ciencia también se baila en el espectáculo artístico-científico sobre biología molecular ‘Molecular Plasticity’. Bajo la dirección artística de Roberto Torres, de La Ciencia al Teu Món, combina música original, imágenes creativas, danza contemporánea e ideas científicas que aún no han llegado a los libros de texto y al público en general. Está basado en el libro de divulgación científica ‘¿Qué sabemos de… las proteínas dúctiles?’, escrito por Inmaculada Yruela y publicado por CSIC-Catarata (2016). El espectáculo ‘Molecular plasticity’, producido con la ayuda de la Fundación Española para la Ciencia y la Tecnología-Ministerio de Ciencia, Innovación y Universidades, se estrenó en las jornadas de Divulgación Innovadora D+i 2018 y se ofrece el día 27 de abril, a las 18.00, en el Centro Cívico Santa Isabel.

Una bailarina arropada por luces y proyecciones introduce en el primer acto los conceptos clásicos de la biología estructural y muestra cómo se relaciona la estructura de las proteínas con su función. El segundo acto presenta a las proteínas dúctiles –proteínas que carecen de una estructura definida– como algo difuso, sin forma, y cuenta el importante cambio de paradigma que ha supuesto su conocimiento para la biología molecular: lo flexible, lo dúctil es útil y puede desempeñar una función. Así lo expresa una mínima coreografía que da vida a diferentes partes del argumento. En el tercer acto, el público entra a formar parte del espectáculo. A modo de juego, seis voluntarios suben al escenario y componen distintas formas de proteínas con elementos flexibles y rígidos. El público se ve envuelto en una dinámica interactiva y se siente interpelado por una conclusión: lo raro, incluso lo informe, puede ser clave para salir de situaciones difíciles o angustiosas. Ser ‘diferente’ o ‘irregular’ no tiene por qué ser una desventaja o un defecto.
Inmaculada Yruela Guerrero Investigadora científica, Estación Experimental de Aula Dei-CSIC
-Ir al suplemento Tercer Milenio