Tercer Milenio

En colaboración con ITA
Investigación
Criomicroscopía de proteínas: máquinas celulares a nivel atómico frente al párkinson y la epilepsia
El grupo NeuroBioSys del BIFI estudia la estructura de receptores de dopamina y glutamato en busca de tratamientos para el párkinson y la epilepsia.
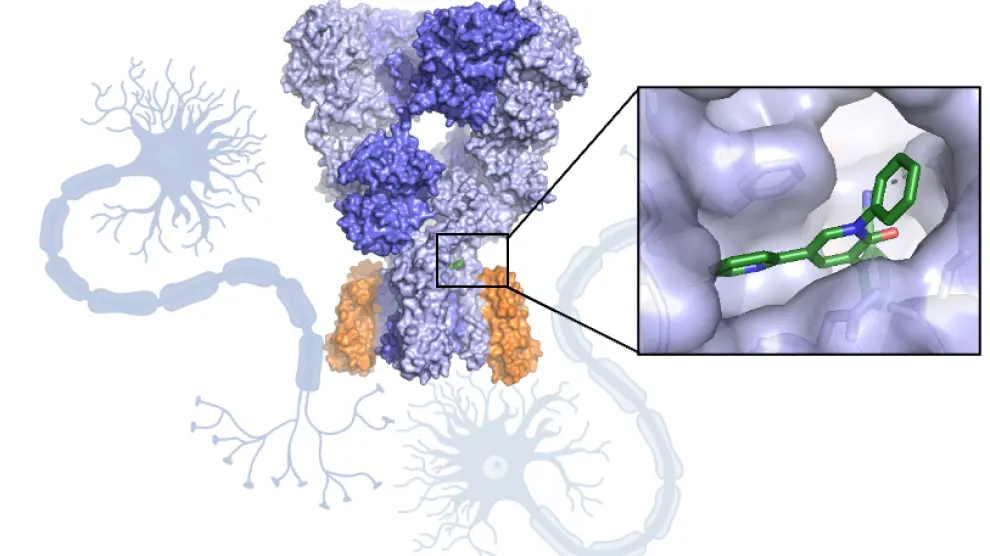
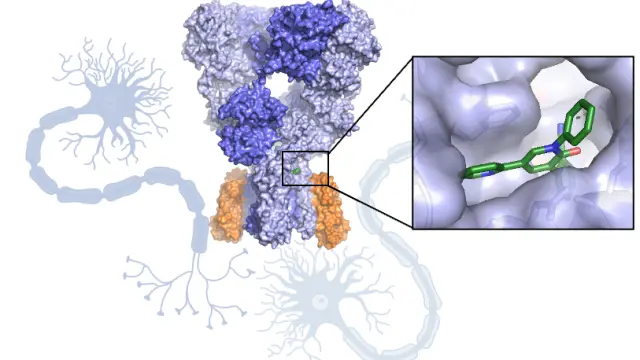
Las proteínas son pequeñas máquinas celulares que desempeñan multitud de funciones, desde catalizar reacciones hasta formar fibras musculares y participar en la defensa del organismo. Estas funciones tan diversas dependen de la estructura atómica. Desde el grupo NeuroBioSys (BIFI) de Unizar exploramos la estructura de receptores de neurotransmisor con el fin de identificar posibles rutas de tratamiento, utilizando la criomicroscopía electrónica, una técnica que está viviendo una revolución sin precedentes.
Tras casi dos años de pandemia, en noviembre de 2021, empezaron a circular noticias de una nueva variante muy contagiosa de SARS-CoV-2, llamada Ómicron. Apenas dos semanas más tarde, el microscopista Sriram Subramaniam presentaba en Twitter la estructura atómica de la proteína de espícula del virus unida al receptor humano ACE2, mostrando cómo las mutaciones en Ómicron mejoraban la unión al receptor y explicaban su alta transmisibilidad.
Este es solo un ejemplo de las más de 1.500 estructuras relacionadas con el coronavirus publicadas en apenas cuatro años: muchas de ellas señalan la unión de potenciales fármacos a proteínas víricas; otras enseñan cómo los anticuerpos interaccionan con el virus; todas ellas ilustran el enorme potencial de la criomicroscopía electrónica y la biología estructural.
En el campo de la neurobiología, la criomicroscopía ha permitido visualizar a nivel atómico las fibras que se depositan en el cerebro de pacientes de alzhéimer o la estructura de receptores de neurotransmisores esenciales para la comunicación neuronal.
Desde 2020, el grupo NeuroBioSys del Instituto de Biocomputación y Física de Sistemas Complejos (BIFI-Unizar) indaga en la estructura de receptores de dopamina y glutamato. Se trata de importantes dianas para el tratamiento del párkinson y la epilepsia, pero hasta ahora los fármacos desarrollados presentan importantes efectos secundarios debido a su baja especificidad.
En ambos casos, existen proteínas diferentes formando los receptores en distintas regiones cerebrales y los fármacos actúan de manera inespecífica sobre todos ellos. El objetivo de NeuroBioSys es explorar la estructura atómica de receptores de diferentes regiones cerebrales y de receptores unidos a fármacos con el fin de identificar nuevas rutas para el desarrollo y generación de fármacos más específicos.
En detalle
- Objetivo Analizar la estructura de receptores de neurotransmisor involucrados en patologías del sistema nervioso.
- Socios Investigadores del grupo NeurobioSys de la Universidad de Zaragoza.
- Financiación Cinco proyectos I+D de la Agencia Estatal de investigación y el Fondo Social Europeo dotados con 902.000 euros.
- Periodo de ejecución Desde junio de 2020 hasta agosto de 2026.
- Más información
¿Cómo usar las estructuras de proteínas para el desarrollo de fármacos?
La mayoría de los fármacos se unen a proteínas diana adaptándose a las cavidades proteicas igual que una llave se adapta a una cerradura. Algunos fármacos se unen a una sola diana mientras que otros se unen a muchas y desencadenan efectos secundarios. Al visualizar la estructura atómica de una proteína unida a un fármaco se puede comprender cómo actúa e introducir modificaciones en el mismo para que se adapte mejor a la proteína.
Además, las estructuras permiten identificar sitios potenciales de unión para realizar después un diseño racional de fármacos. Para ello, se utilizan métodos computacionales y se simula la unión de millones de moléculas a las cavidades proteicas; después, estas moléculas se sintetizan y la unión a la proteína diana se evalúa experimentalmente.
¿Por qué usar un microscopio electrónico para visualizar proteínas?
Las proteínas rara vez pasan de unos pocos nanómetros (la millonésima parte de un milímetro) y están compuestas de miles de átomos que forman estructuras tridimensionales muy diversas.
De manera similar al microscopio óptico, que consta de una lámpara y un conjunto de lentes que aumentan varios cientos de veces el tamaño de las muestras, el microscopio electrónico utiliza como fuente de radiación electrones acelerados a velocidades cercanas a la de la luz, lentes magnéticas y detectores directos de electrones que permiten alcanzar resoluciones atómicas.
Para observar proteínas en el microscopio es necesario congelarlas en una fina capa de hielo a temperaturas inferiores a -180 °C. Se toman miles de imágenes en microscopios dotados de detectores extremadamente sensibles y se utiliza un clúster de supercomputación para procesar las imágenes obtenidas y generar una estructura atómica.
En los últimos años, el desarrollo de nuevos detectores y programas informáticos ha producido un salto extraordinario en la calidad de los datos y la criomicroscopía electrónica es hoy la técnica más utilizada para estudiar proteínas de gran tamaño, complejos de varias proteínas, virus y células. Esta revolución culminó en el año 2017 con el premio Nobel de Química de Richard Henderson, Joakim Frank y Jacques Dubochet por su papel en el desarrollo de la técnica.
¿Por qué estudiar la estructura de receptores de glutamato?
Las sinapsis son los puntos de comunicación entre neuronas. En ellas, una neurona libera una señal química (el neurotransmisor), que se une a receptores de la siguiente neurona y genera una señal eléctrica que permite la transmisión del impulso nervioso.
Los receptores de glutamato son esenciales para la comunicación neuronal y están compuestos por distintas proteínas dependiendo de la región cerebral y etapa del desarrollo. En enfermedades como la epilepsia o la esclerosis lateral amiotrófica, la comunicación a través de estos receptores es defectuosa, lo que los convierte en dianas farmacológicas. Nuestro objetivo es comprender las diferencias estructurales de receptores en distintas partes del cerebro con el fin de identificar sus particularidades. Estas estructuras sentarán las bases para el diseño racional de fármacos más específicos y que generen menos efectos secundarios.
Beatriz Herguedas Francés investigadora Ramón y Cajal del grupo NeuroBioSys del instituto BIFI-Unizar
Con la colaboración de la Unidad de Cultura Científica de la Universidad de Zaragoza
-Ir al suplemento Tercer Milenio
Apúntate y recibe cada semana en tu correo la newsletter de ciencia