Tercer Milenio

En colaboración con ITA
Nuevas terapias y nuevos desafíos frente al cáncer
El cáncer no es una enfermedad, sino un conjunto de ellas y, gracias a la investigación, cada vez entendemos mejor los mecanismos que hay detrás. ¿Cómo ha sido la evolución en los tratamientos? ¿Cuáles son los más punteros? ¿Qué barreras quedan por superar?
Cáncer es una palabra que aún nos asusta. Prácticamente todos conocemos, de forma más o menos cercana, el caso de alguien que murió de cáncer. Pero, realmente, tenemos cáncer porque estamos vivos. Porque somos cuerpos en constante recambio celular. Los cánceres son consecuencia de nuestra propia complejidad, y de que cada vez vivimos más tiempo.
Tenemos tantísimas células (unas 40.000.000.000.000), y nuestras células tienen tantísimas letras dictando nuestras propias instrucciones (nuestro ADN, que contiene todos nuestros genes), que de vez en cuando algunos genes mutan y escapan a nuestros mecanismos de reparación. Estos errores se van acumulando con los años, a menudo con la ayuda de agentes externos como el tabaco, y alguna célula rebelde se descontrola dando lugar a un tumor.
Se estima que el cáncer representa una de cada 6 muertes, sumando más de 10 millones al año. Pero es importante poner las cosas en perspectiva. Los avances extraordinarios que han tenido lugar en los últimos 80 años nos permiten comprender, diagnosticar y tratar el cáncer hoy en día. La piedra angular de este progreso siempre ha sido, y sigue siendo, la investigación. Los esfuerzos incansables de innumerables científicos, médicos y pacientes.
El cáncer no es una sola enfermedad, lo que significa que no hay una sola cura. El cáncer es una colección muy compleja de enfermedades, más de 150. Cuando hablamos de enfermedades víricas, no confundimos gripe, con ébola o con coronavirus, ¿no? De la misma forma, no es lo mismo un cáncer de próstata que un cáncer de páncreas. Y dentro de un mismo tipo de cáncer, hay diferencias entre pacientes. Además, un tumor cambia con el tiempo, evoluciona, busca sobrevivir. Esto da una idea de la complejidad del asunto.
Hemos tardado décadas en entender todo esto, en edificar el conocimiento imprescindible sobre la biología del cáncer. Si bien es un importante problema de salud global, la lucha contra él ha sido, y continúa siendo, acorde a su magnitud. Nuestro pasado más reciente demuestra que estamos plantándole cara cada vez mejor: desde 1992, ha habido casi 25 años consecutivos de disminución en incidencia general y en tasa de mortalidad para todos los tipos de cáncer. Además, de acuerdo con las estimaciones de la Agencia Americana de Oncología Clínica, hasta 2026 se espera un aumento del 31% en supervivencia global tras un diagnóstico de cáncer.
Paso a paso ¿Cómo ha sido la evolución en los tratamientos contra este conjunto de enfermedades? ¿Cuáles son los tratamientos más punteros hoy en día? ¿Qué barreras quedan por superar?
Una primera revolución en la terapia contra el cáncer ocurrió en la década de 1940 con los primeros agentes antiproliferativos, las mostazas nitrogenadas, desarrolladas originalmente para fines de guerra. Fueron reutilizadas para el tratamiento de cánceres hematopoyéticos (que afectan a la sangre e incluyen leucemias, linfomas y mielomas múltiples) y son considerados el origen de la famosa quimioterapia.
Muchos de estos fármacos antiproliferativos (quimioterapia clásica) bloquean la división de las células. Si bien la proliferación descontrolada de las células cancerosas las hace más susceptibles a estos tratamientos, también afectan a las células sanas. Los efectos son particularmente importantes en tejidos con alto recambio celular, provocando efectos secundarios como anemia, pérdida de cabello, trastornos gastrointestinales o nefrotoxicidad.
La segunda revolución la protagonizaron las terapias dirigidas, que abarcan todos aquellos tratamientos que atacan dianas específicas involucradas en la transformación neoplásica. Esto incluye fármacos obtenidos por síntesis química y medicamentos biológicos (proteínas recombinantes y terapias celulares). Tienen efectos secundarios menores en comparación con los agentes antiproliferativos.
Actualmente vivimos la revolución de la inmunoterapia y estamos empezando a ver la degradación dirigida de proteínas aplicada a pacientes.
Superar los retos pendientes será posible, como siempre, a medida que avance la investigación, por lo que un desafío clave, más allá de entender la complejidad del cáncer, es convencer a los políticos de que invertir en investigación funciona. Lo dice la historia del cáncer. Y lo dijo con estas palabras el prestigioso investigador Mariano Barbacid: "Lo sabemos todos menos los políticos: sin investigación será imposible seguir avanzando contra el cáncer".
Terapias y desafíos
Un paciente con cáncer a principio del siglo XX solo tenía como opción la cirugía y la radioterapia. A partir de los cuarenta, empezaron a aparecer las primeras quimioterapias. Los fármacos quimioterapéuticos clásicos atacan la división celular. Pero atacar un proceso celular fundamental tiene un precio: las células sanas también sufren, produciendo efectos secundarios no deseados. Por eso, la siguiente ola de tratamientos puso el foco en conseguir una mayor selectividad y personalización.
Empezó en la década de 1980 y se aceleró con la secuenciación completa del genoma humano a principios del siglo XXI. La clave fue la comprensión cada vez mayor de los mecanismos moleculares del cáncer. Comenzaba la era de las terapias dirigidas. Empezamos a atacar dianas concretas: funciones celulares clave, proteínas malignas producto de genes con mutaciones, diferentes según el tumor o incluso el paciente. Tienen menos efectos secundarios que la quimio clásica, con una mejora significativa en las tasas de supervivencia. Incluyen fármacos obtenidos por síntesis química llamados ‘inhibidores’ y medicamentos biológicos como anticuerpos o proteínas recombinantes. Sus limitaciones podrían ser superadas por una estrategia en marcha: la degradación dirigida de proteínas.
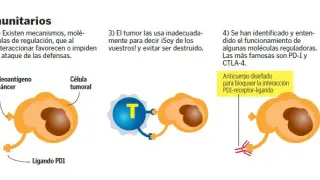
La gran revolución que vivimos actualmente viene liderada por la inmunoterapia. James P. Allison y Tasuku Honjo ganaron el Nobel en 2018 por sus trabajos pioneros en este campo. El cuerpo humano tiene su propio sistema de defensa, el sistema inmunitario, y estos tratamientos -los más punteros son las terapias CAR-T- tratan de usarlo para luchar contra el cáncer.
Nos encontramos en un periodo llamado a ser revolucionario. Parece que por fin contamos con el conocimiento y las tecnologías necesarias para combatir el cáncer de tú a tú. Empezamos a ganar batallas, continúa la explosión de herramientas de ingeniería genética como Crispr, entendemos mejor el origen los tumores o las claves de las metástasis. Entonces, ¿a qué desafíos clave nos enfrentamos hoy? Si hablamos de inmunoterapia, solo una parte de los pacientes responden. Es imprescindible entender mejor por qué. Y se espera poder desarrollar tratamientos CAR-T para otras neoplasias hematológicas o, incluso, tumores sólidos.
En relación con la quimioterapia convencional y las terapias dirigidas, aunque la mayoría de los pacientes experimentan una fase inicial de respuesta muy buena, la resistencia a estos tratamientos surge casi inevitablemente unos meses después.
El enfoque más prometedor para el tratamiento a largo plazo radica en combinar medicamentos para prevenir o retrasar la aparición de resistencia. Idealmente, usando fármacos sintetizados químicamente, que evitan los problemas logísticos de los medicamentos biológicos. Los segundos son, de momento, mucho más caros, y por tanto difícilmente sostenibles en los sistemas de salud occidentales e inaccesibles para los países en desarrollo.
Publicaciones internacionales incluyen además los siguientes retos a corto plazo: aumentar las terapias dirigidas en cánceres pediátricos y cánceres raros, aumentar el acceso equitativo a ensayos clínicos, reducir las consecuencias adversas del tratamiento del cáncer o diagnosticar mejor las lesiones premalignas.
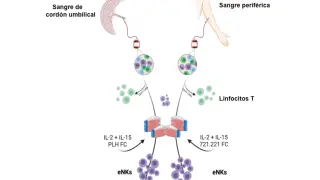
Las terapias CAR-T usan el propio sistema de defensa del cuerpo, el sistema inmunitario, para luchar contra el cáncer. Se basan en el uso de la propia sangre del paciente, concretamente sus linfocitos T, células especializadas en matar cuerpos extraños. Las células tumorales ‘aprenden’ a esconderse, pero se ha demostrado que es posible extraer los linfocitos T del paciente, modificarlos para que detecten las células cancerosas, y volver a inocularlos en la sangre. Han demostrado una eficacia espectacular, curativa, en algunos tipos de cáncer de la sangre.
Degradación dirigida de proteínas: aumentan las dianas atacables
La mayor limitación de los fármacos inhibidores desarrollados hasta ahora es que no permiten atacar a todas las proteínas malignas. Si imaginamos estas proteínas como cerraduras, la mayoría de los fármacos actúan como una llave que encaja perfectamente y consigue dejar fuera de juego a esa proteína. Pero solo tenemos llaves para entre el 10 y el 20% de todas las proteínas.
Un abordaje terapéutico extremadamente novedoso que puede resolver este problema es la degradación dirigida de proteínas. Actualmente es ya una realidad clínica para el tratamiento del mieloma múltiple. Además, desde 2019 se encuentra en ensayos clínicos contra cáncer de mama y próstata promovidos por la farmacéutica Arvinas. En 2021 ha habido una explosión maravillosa de ensayos clínicos motivada por el enorme potencial de esta estrategia: un total de 16 estudios ya han empezado o empezarán a lo largo de este año, respaldados por grandes compañías farmacéuticas como C4 Therapeutics, Bristol Myers Squibb o Novartis.
La degradación dirigida de proteínas se basa en el uso de fármacos llamados degradadores, pequeñas moléculas que ‘engañan’ a la maquinaria de degradación proteica, que todos tenemos en nuestras células, para conseguir que elimine de forma selectiva las proteínas malignas que sustentan a un tumor.
El concepto es relativamente simple, estos degradadores cuentan con dos ‘brazos’: uno se une a la proteína maligna que queremos destruir, y el otro se une a la maquinaria implicada en marcar proteínas para su destrucción en nuestras células.
Los degradadores suponen un cambio de paradigma en lo que a desarrollo de fármacos se refiere: no es necesario ‘inhibir’, basta con ‘unir’. Esta particularidad, amplía enormemente el espectro de proteínas atacables, incluyendo importantes dianas hasta ahora inaccesibles para el desarrollo terapéutico.
Engañar para curar Los fármacos degradadores utilizan los mecanismos de destrucción de proteínas que todos tenemos en nuestras células. Engañan a esta maquinaria, para lograr que se dirija a degradar proteínas que son relevantes terapéuticamente. Por ejemplo, proteínas que hacen posible el crecimiento de un tumor. El mecanismo de estos fármacos consiste en forzar un acercamiento entre la maquinaria de destrucción proteica y dichas proteínas malignas.
-Ir al suplemento Tercer Milenio
Apúntate y recibe cada semana en tu correo la newsletter de Tercer Milenio