Tercer Milenio

En colaboración con ITA
Genética. Tres padres para un hijo sano
Hace apenas medio año nacía en México el primer bebé concebido con la denominada técnica de los tres padres genéticos. Un controvertido procedimiento de reemplazo mitocondrial, pendiente aún de aprobación oficial, que permite a las mujeres portadoras de mutaciones en el ADN mitocondrial que afectan al funcionamiento de estos constituyentes celulares causando graves enfermedades dar a luz hijos sanos sin renunciar a que estos hereden su material genético nuclear, sus genes. Honra merece quien a sus padres se parece.
Dos madres y un padre para engendrar un bebé sano. Eso es lo que implica la técnica de transferencia del huso mitótico (spindle transfer technique) o, como se ha dado en llamar -de forma harto imprecisa- en los medios de comunicación, técnica de los tres padres genéticos.
Para la inmensa mayoría, estos nombres no significarán nada. Pero pueden suponerlo todo para unos pocos: aquellas parejas y mujeres que desean tener hijos biológicos pero que están condenados a no tenerlos o a perderlos al portar la madre, en su ADN mitocondrial, alguna mutación genética responsable de una enfermedad o síndrome en muchos casos fatal para el recién nacido. Algo que generalmente han descubierto a través de dolorosas pérdidas previas.
Y lo puede suponer todo porque ya hace medio año que nació el primer niño, sano y libre de la condición de la que es portadora su madre, gracias a dicha técnica o tratamiento de fertilización.Manual de instrucciones para ponerse las pilas
Para entender en qué consiste el procedimiento hay que partir de la base de que en las células humanas conviven dos tipos de material genético. Por un lado, el ADN nuclear, constituido por los 23 pares de cromosomas heredados de ambos progenitores y que contiene unos 20.000 genes que codifican la información que nos define, que determina nuestra individualidad. Por otro, una pequeña cantidad de ADN mitocondrial, presente en el interior de las mitocondrias. Orgánulos celulares localizados en el citoplasma, el medio celular, y cuya función principal es generar energía para el funcionamiento de la célula. En cierto sentido, son las baterías, pilas o motores de la célula.
Las mitocondrias, y por tanto el ADN mitocondrial, se heredan exclusivamente por vía materna lo que significa que pasa inalterado de madre a hijos o hijas. Dicho ADN contiene 37 genes que codifican enzimas responsables de regular el funcionamiento de la mitocondria. Un fallo o una mutación en uno de estos genes se puede traducir en un mal funcionamiento de las baterías celulares, lo que a su vez puede desembocar en una enfermedad que afecte al desarrollo de algunos de los órganos que requieren un gran suministro de energía, como el cerebro o los músculos. Y suele resultar fatal para el infante, ya que no existe cura o tratamiento eficaz para casi ninguna de estas enfermedades de naturaleza mitocondrial.Mitocondrias en fuera de juego
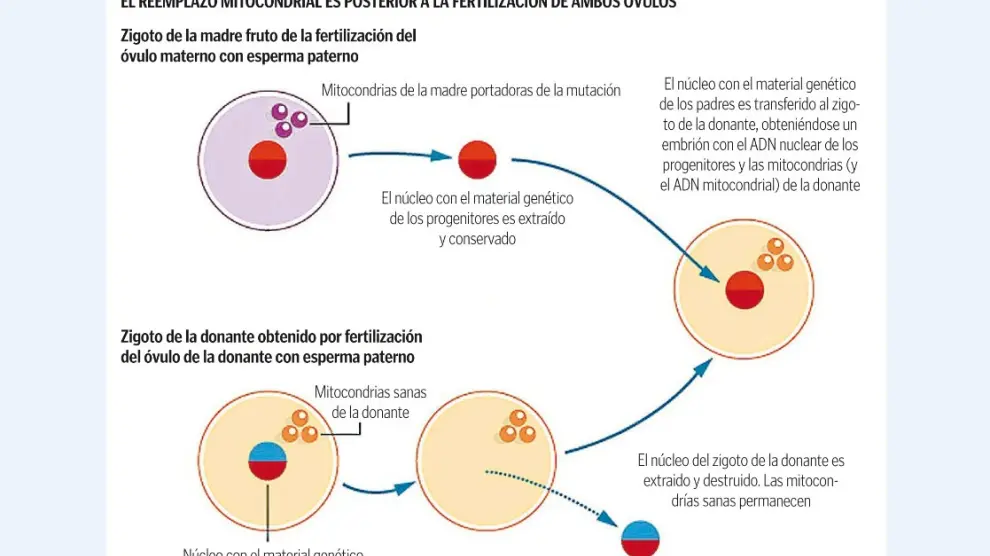
Las técnicas de reemplazo mitocondrial, como su nombre sugiere, consisten en sustituir las mitocondrias de la madre, portadoras del gen defectuoso, por las de una donante sana, manteniendo el resto del material genético, el ADN nuclear, aportado por los padres biológicos.
Actualmente hay dos procedimientos gemelos para efectuar dicho reemplazo: la técnica de transferencia del huso mitótico y la técnica de transferencia pronuclear.
Esta última, de hecho, fue aprobada en Reino Unido en 2015, aunque de momento no se ha llegado a aplicar, al menos oficialmente*. En la transferencia pronuclear, tanto el óvulo de la madre como el de la donante son fertilizados con el esperma paterno de forma simultánea, obteniéndose dos zigotos. A continuación se retira el núcleo apenas formado de ambos y se inserta el procedente del zigoto materno en el zigoto de la donante, obteniéndose un embrión con el ADN nuclear de los padres y las mitocondrias sanas de la donante que se transfiere al útero materno, donde se completará la gestación.
La principal limitación de esta técnica es que una pequeña porción del citoplasma que rodea al pronúcleo se transfiere junto al mismo, con lo que se introducen mitocondrias maternas en el embrión: en torno a un 2% del total. Y aunque se considera que es necesario un porcentaje mínimo de alrededor del 18% para que la enfermedad se manifieste, otros estudios sugieren que a partir de 1% puede resultar peligroso debido a la sospecha de que las mitocondrias defectuosas no solo se replican, sino que pueden hacerlo incluso a mayor ritmo.
En la técnica de transferencia del huso mitótico, se extrae el núcleo, o mejor dicho el material genético nuclear, del óvulo de la madre justo en el momento en que este comienza a preparase para la división celular y se forma el huso mitótico, una red de microtúbulos que se unen a los cromosomas para facilitar su escisión en dos juegos, al tiempo que la pared nuclear comienza a deshacerse. Y se hace lo propio con el óvulo de la donante. A continuación se introduce el material nuclear de la madre en el óvulo desnucleado de la donante, obteniéndose de esta manera un óvulo, con el ADN nuclear materno y las mitocondrias sanas de la donante, que es fertilizado con el esperma paterno y transferido al útero de la madre, donde seguirá el embarazo.
Con esta técnica se asegura que la transferencia de mitocondrias maternas sea inferior a ese crítico 1%. En contrapartida, existe el riesgo de que parte de los cromosomas maternos se desprendan del huso durante la extracción y se pierdan en el proceso, o que alguno de los de la donante, al desprenderse, permanezca en el óvulo y en consecuencia que el embrión resultante tenga una dotación cromosómica anómala. A fin de garantizar que esto no suceda se producen una serie de embriones y finalmente se elige uno que muestre un desarrollo normal.
Y del mismo modo, ¿cómo la presencia y convivencia de mitocondrias de distinta procedencia en la misma célula pueden llegar a afectar en el futuro?Precedentes
Esta reticencia se sustenta en los desalentadores precedentes, que se remontan a finales de la década de 1990, cuando el embriólogo Jacques Cohen, uno de los pioneros en la vía triparental, ensayó la alternativa de introducir un 10-15% de citoplasma del óvulo de la donante en el óvulo materno y así introducir mitocondrias sanas que propiciasen el correcto desarrollo del feto. Entre 1996 y 2001 realizó este procedimiento en 37 ocasiones, con el resultado de 17 bebés de 13 parejas distintas, lo cual constituía ya de por sí un éxito. Sin embargo, solo dos de los recién nacidos presentaban niveles detectables de mitocondrias de la donante. Y ambos desarrollaron desórdenes genéticos.
De momento, el niño engendrado este año con la técnica spindle transfer está sano, pero solo es un caso y apenas ha cumplido medio año.
No obstante, las principales críticas y debates son de naturaleza ética y moral: la destrucción de embriones fecundados que implica el procedimiento de la transferencia pronuclear. La posibilidad de que el ADN mitocondrial de alguna forma pueda afectar o determinar características del individuo y de su personalidad. Y, sobre todo, que este tipo de procedimientos suponen un paso más hacia el diseño de la progenie: hijos a la carta.
Fue entonces cuando acudieron al New Hope Fertility Center (EE. UU.) en busca, no de una solución, sino casi de un milagro. El doctor John Zhang les planteó la opción de recurrir a un nuevo procedimiento, la transferencia de huso mitótico, que permitía eliminar las mitocondrias maternas. Pero había un problema, la técnica todavía estaba pendiente de ser aprobada por la FDA, la agencia gubernamental estadounidense responsable de cuestiones médicas. Había que esperar. Pero ellos no querían, no podían esperar más. El doctor Zhang decidió entonces realizar el tratamiento en México aprovechando el vacío legal existente allí. Hace seis meses nació su hijo. Felizmente sano y libre de la fatal dolencia. Al menos por ahora. Los análisis efectuados indican que presenta menos de un 1% de mitocondrias portadoras del gen defectuoso.
Precisamente el estudio del genoma nuclear en patologías de esta naturaleza es el campo de investigación que pretende abordar el nuevo equipo de trabajo, liderado por la investigadora Pilar Bayona, que el departamento de Bioquímica y Biología molecular de la Universidad de Zaragoza ha puesto en marcha tras la firma, en julio de este año, de un convenio de colaboración con al Asociación de Enfermos de Patología Mitocondrial.
Más en concreto, el objetivo es determinar cuáles de las mutaciones identificadas en el ADN nuclear en los últimos años gracias a la aplicación de nuevas técnicas de secuenciación genómica, son patológicas y causantes de este tipo de dolencias. Ya que, como destaca Pilar Bayona, "no todas las mutaciones en el ADN son patológicas; confirmar que una mutación causa una enfermedad es muy importante para el diagnóstico y consejo genético y, a largo plazo, para el tratamiento".
Para lograrlo, la forma en que proceden es, en primer lugar, buscar la mutación en el genoma de los progenitores, lo cual constituye un revelador indicio. A continuación se efectúan pruebas funcionales en células de la piel del paciente para comprobar la patología que la mutación produce. Primero se identifica y se estudia el daño provocado por la mutación en la célula y después se introduce en esta el gen sano para observar si recupera su operatividad normal.
*Actualización:
El 15 de diciembre de 2016, la Autoridad de Embriología y Fertilización Humana (HFEA) dio luz verde definitiva a esa técnica para poder poner en práctica en el Reino Unido. El Parlamento británico aprobó en 2015 la fecundación de bebés a partir del ADN de tres progenitores diferentes con el fin de evitar las enfermedades congénitas.